Сегодня много говорят о новых возможностях современной медицины в вопросах долголетия.
О препаратах, которые позволяют избавиться от ряда тяжелых заболеваний, в том числе онкологии, диабета, и, по сути, продлить полноценную жизнь человека.
Один из последних шагов в этом направлении – только что завершившееся исследование по активизации митохондрий в свете митохондриальной теории старения. Согласно этой теории, начиная с рождения и в течение жизни человека, в его митохондриальной ДНК накапливаются мутации. Способность митохондрий вырабатывать энергию снижается, процессы естественной гибели клеток начинают преобладать над делением, обновление замедляется и организм стареет.
Основным источником мутаций митохондриальной ДНК являются активные формы кислорода. Существует мнение, что уменьшение их количества в митохондриях снижает число вновь образующихся мутаций митохондриальной ДНК и таким образом продлевается жизнь клетки, увеличивая тем самым продолжительность жизни человека.
Митохондрии это небольшие, но важные клеточные органеллы (можно сказать, что это внутренние органы клетки), служащие энергетическими батареями для выполнения практически всех функций человеческого организма – их активная работа является гарантией здоровья и долголетия.
Группа ученых под руководством доктора наук В.Н. Ласкавого разработала и запатентовала во многих странах мира ((патент РФ № 2765467) препарат, на основе 0,07% раствора метаналя, (альдегида муравьиной кислоты), который позволяет стимулировать работу этих важнейших для человека частичек клеток, которые, образно говоря, помогают дышать и активно действовать всему организму. Основным действующим веществом препарата является метаналь, формальдегид, одно из простейших соединений в природе.
Установлено, что в живых организмах имеется эндогенный формальдегид, который является естественным метаболитом и участвует во многих биохимических реакциях организма. Известно, что формальдегид легко проникает во все клетки и легко удаляется при превышении концентрации его физиологической нормы.
Физиологический уровень формальдегида в организме постоянно поддерживается за счет непрерывного действия клеточных ферментов. Он легко взаимодействует с белками, аминами, амидами, нуклеопротеидами, нуклеиновыми кислотами и обнаруживается во всех внутренних жидкостях человека и животных.
Результаты оценки деятельности митохондрий показали, что через несколько часов после введения препарата мышам происходит активация митохондрий. Эти процессы выявлены в разные сроки после введения препарата и в различных клеточных популяциях.
Таким образом, подтверждено влияние экспериментального препарата на мембранный потенциал митохондрий клеток крови лабораторных животных. Препарат вызывает поляризацию внутренних мембран митохондрий, приводя их к активизации и усиливая аэробное окисление и, следовательно, более интенсивную выработку энергии.
Проведенные исследования показали, что применение экспериментального препарата позволяет эффективно лечить онкологические заболевания (патент ЮАР № 2010/05416, патент КНР CN № 101925351, патент Индия № 288329), проводить иммунокоррекцию при различных нарушениях иммунитета (патент РФ № 2077882), лечить вирусные и бактериальные инфекции (патент РФ № 2146134, Евразийский патент №046210, патент ЮАР №2022/117706), нормализовать уровень холестерина (патент РФ № 2352331, патент РФ № 2352331, патент Японии № 5095818, патент Сингапура № 156858, патент Европейского патентного ведомства ЕРР № 2172195, патент США № 8497259), активизировать собственные стволовые клетки организма (патент РФ № 2376985, патент Европейского патентного ведомства ЕРР № 2305223).
В 2005 году препарат прошел ограниченные и расширенные клинические испытания в Республике Беларусь и получил сертификат № 05/05/1266 от 26.05.2005 на производство и применение препарата в медицине.
Возможность активации митохондрий и, следовательно, снижение возможных мутаций в митохондриальной ДНК является на наш взгляд ключевым моментом, позволяющим в дальнейшем добиться значительного увеличения продолжительности жизни организма человека.
Статью, опубликованную в журнале «Грани успеха» №1 (12/2024), о ходе экспериментов и выводами ученых, приводим ниже:
УДК 615.03:576.08:57.021
Использование нового препарата на основе метаналя для активизации митохондрий
Ласкавый В.Н.1, Шурдов М.А.2,Гривцова Л.Ю.3, Полянина Т.И.1, Голова А.Б. 1, Симоненко Н.В.1, Кузнецова А.Е.1, Ласкавая В.В.1 Тарасенко Т.Н. 1
1Общество с ограниченной ответственностью «САРБИОТЕХ», 410037, Саратовская область, г. Саратов, ул. Усть-Курдюмская, д. 4, к. 174, Российская Федерация.
2Акционерное общество Клинический госпиталь "Нейровита",121359 г. Москва ул. Маршала Тимошенко, 7с1, Российская Федерация.
3Медицинский радиологический научный центр имени А.Ф. Цыба – филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации», 249031, Калужская область, г. Обнинск, ул. Маршала Жукова, д. 10г. Российская Федерация
В статье представлены результаты исследований разработанного препарата на основе 0,07% раствора метаналя (альдегида муравьиной кислоты) на активизацию митохондрий. Доказана его способность вызывать поляризацию внутренних мембран митохондрий в клетках крови биомоделей, приводящую к их активизации и более интенсивной выработке энергии (патент РФ № 2765467). Наибольший эффект проявляется через сутки и сохраняется до трех недель после однократного введения препарата.
митохондрий. Доказана его способность вызывать поляризацию внутренних мембран митохондрий в клетках крови биомоделей, приводящую к их активизации и более интенсивной выработке энергии (патент РФ № 2765467). Наибольший эффект проявляется через сутки и сохраняется до трех недель после однократного введения препарата.
Активация митохондрий выявлена на различных клеточных популяциях и зависит от времени после введения препарата. На ранних сроках наибольший эффект проявляется в моноцитах, а позже – в лимфоцитах.
Возможность активации митохондрий и, следовательно, возможное снижение мутаций в митохондриальной ДНК является, на наш взгляд, ключевым моментом, позволяющим в дальнейшем добиться значительного увеличения продолжительности жизни организма млекопитающих.
Долголетие, продление молодости, торможение старения являются одним из основных вопросов, которые всё чаще обсуждаются в современном обществе. Исследования этой проблемы долголетия ведутся в мире не одно столетие и создано много обоснованных теорий старения, выделяющих в качестве основной причины нарушения функционирования тех или иных систем организма.
Особый интерес представляет митохондриальная теория старения, которая относится к группе свободно-радикальных теорий. Согласно этой теории, начиная с рождения и в течение жизни человека, в его митохондриальной ДНК накапливаются мутации. Способность митохондрий вырабатывать энергию снижается, процессы естественной гибели клеток начинают преобладать над делением, обновление замедляется и организм стареет. Основным источником мутаций митохондриальной ДНК являются активные формы кислорода. Существует мнение, что уменьшение их количества в митохондриях снижает число вновь образующихся мутаций митохондриальной ДНК и таким образом продлевается жизнь клетки, увеличивая тем самым продолжительность жизни человека [3].
Известно, что митохондрии – это двумембранные органоиды, присутствующие в каждой эукариотической клетке и называемые полуавтономными органоидами, «энергетическими станциями» клетки, имеющими наружную гладкую мембрану и внутреннюю складчатую. Основной задачей митохондрий является образование молекул аденозинтрифосфорной кислоты или АТФ (энергия, используемая клеткой для обеспечения своей жизнедеятельности) в биохимических циклах клеточного дыхания. Митохондрии также участвуют в метаболизме аминокислот, липидов, холестерина, стероидов и нуклеотидов и механизмах апоптоза (программируемой гибели клетки) [8, 9, 13, 16].
В последнее время особое внимание уделяется изучению возможности активации митохондрий и управления этим процессом, поскольку активизация метаболических процессов в митохондриях согласно митохондриальной теории старения может привести к продлению жизни.
Разработан экспериментальный препарат, который оказывает комплексное воздействие на организм, способствует сохранению молодости и поддержанию гомеостаза. Основным действующим веществом является метаналь (формальдегид), одно из простейших соединений в природе. Установлено, что в живых организмах имеется эндогенный формальдегид, который является естественным метаболитом и участвует во многих биохимических реакциях организма. Концентрация эндогенного формальдегида может достигать 0,2-0,5 мМ, и его содержание в крови 0,05-0,1 мМ [5, 15]. Известно, что формальдегид легко проникает во все клетки и легко удаляется при превышении концентрации его физиологической нормы. Физиологический уровень формальдегида в организме постоянно поддерживается за счет непрерывного действия клеточных ферментов, окисляющих формальдегид [5]. Формальдегид используется организмом для синтеза нуклеиновых кислот, образуется при разрушении серина и в меньшей степени – других аминокислот.
Формальдегид легко взаимодействует с белками, аминами, амидами, нуклеопротеидами, нуклеиновыми кислотами [10]. Он обнаруживается во всех внутренних жидкостях человека и животных в небольших количествах и только в моче его на 20% больше, чем, например, в крови, что указывает на основной способ его выведения из организма.
Исследования показали, что низкие концентрации формальдегида (например, 10 ммоль/л) способствуют пролиферации клеток HeLa. Однако, когда концентрация формальдегида достигает 62,5 ммоль/л, он ингибирует рост клеток. Определенная концентрация формальдегида в организме важна для жизнедеятельности клеток, так как эндогенный формальдегид является важным метаболитом, однако, в случае сильного повышения концентрации, он может действовать и как генотоксин [6].
Проведенные исследования показали, что экспериментальный препарат эффективен при лечении онкологических заболеваний (патент ЮАР № 2010/05416, патент КНР CN № 101925351, патент Индия № 288329), для иммунокоррекции при различных нарушениях иммунитета (патент РФ № 2077882), для лечения вирусных и бактериальных инфекций (патент РФ № 2146134, Евразийский патент №046210, патент ЮАР №2022/117706), в качестве холестеринорегулирующего средства (патент РФ № 2352331, патент РФ № 2352331, патент Японии № 5095818, патент Сингапура № 156858, патент Европейского патентного ведомства ЕРР № 2172195, патент США № 8497259), для активизации собственных стволовых клеток организма (патент РФ № 2376985, патент Европейского патентного ведомства ЕРР № 2305223).
Поскольку период полужизни муравьиного альдегида в крови составляет около 1-1,5 мин [7], то при внутримышечном введении препарата концентрация формальдегида в крови уже через несколько минут возвращается к физиологической норме.
В 2005 году препарат прошел ограниченные и расширенные клинические испытания в Республике Беларусь и получил сертификат № 05/05/1266 от 26.05.2005 на производство и применение препарата в медицине.
Основной задачей наших исследований была оценка влияния экспериментального препарата на активизацию митохондрий организма, а поскольку одним из основных маркеров активации митохондрий является измерение мембранного потенциала митохондрий [1, 14], то именно его мы и решили определить в рамках данного исследования.
Энергия, выделяемая в ходе реакций окисления в митохондриальной дыхательной цепи, хранится в виде отрицательного электрохимического градиента мембраны митохондрий, а мембранный потенциал митохондрий является поляризованным. Ослабление мембранного потенциала митохондрий приводит к его деполяризации, и часто, но не всегда, наблюдается на ранних стадиях апоптоза, также изменения данного показателя описаны во время процессов некроза (в результате деполяризации мембраны) и процессов остановки клеточного цикла (в результате гиперполяризации мембраны). Апоптоз начинается с деполяризации мембраны митохондрий и, предположительно, является предпосылкой для высвобождения цитохрома С [4].
Поэтому для определения степени воздействия препаратов на активизацию митохондрий (анализа мембранного потенциала митохондрий) можно успешно использовать проточную цитометрию в целых клетках. При этом в качестве тестового зонда оптимально использовать мембранопроницаемые липофильные катионные флуорохромы, которые проникают в клетки, и их флуоресценция является отражением разницы мембранных потенциалов. Одним из перспективных флуорохромов является JC-1 (5,5’,6,6’-тетрахлор-1,1’,3,3’-тетраэтил-бензимидазол карбоцианин йодид), который является агрегатобразующим катионным красителем, чувствительным к мембранному потенциалу митохондрий.
Спектр излучения флуоресценции JC-1 зависит от его концентрации, которая, в свою очередь, определяется состоянием мембранного потенциала. JC-1 может существовать в двух различных состояниях, агрегатах или мономерах, каждый из которых имеет разные спектры излучения. JC-1 образует мономеры при низких концентрациях красителя и агрегаты при более высоких концентрациях. Как агрегаты JC-1, так и мономеры проявляют флуоресценцию в зеленом конце спектра, которая измеряется в зеленом канале (FL-1) на проточных цитометрах.
Когда живые клетки инкубируются с JC-1, он проникает в плазматическую мембрану клетки как мономер. Поглощение JC-1 в митохондрии обусловлено мембранным потенциалом. Далее разница мембранных потенциалов нормальных и здоровых митохондрий поляризуется, и JC-1 быстро поглощается такими митохондриями. Это поглощение увеличивает градиент концентрации JC-1, что приводит к образованию агрегатов JC-1 (известных как J-агрегаты) в митохондриях.
Агрегаты JC-1 демонстрируют красный спектральный сдвиг, приводящий к увеличению излучения красной флуоресценции, которое измеряется в красном канале (FL-2) на большинстве проточных цитометров.
Таким образом, на основании оценки количества JC-1green+ (мономеры) и JC1red+ (агрегаты) клеток можно говорить о состоянии мембраны митохондрий в изучаемом пуле клеток, а преобладание JC1red+ (агрегаты) клеток будет косвенно указывать на активацию митохондрий.
Важно, что краситель JC-1 может использоваться как качественная (учитывая сдвиг от зеленого к красному излучению флуоресценции), так и количественная (учитывая только чистую интенсивность флуоресценции) мера мембранного потенциала митохондрий [12].
Накопление флуоресцентных красителей в митохондриях можно оптически обнаружить с помощью проточной цитометрии [14].
Учитывая то, что таким образом изучается не столько активация митохондрий, сколько апоптоз, то для исключения вероятности данного процесса параллельно те же самые клетки крови животных можно изучить на предмет количества BCL-2+ клеток с применением метода многопараметровой проточной цитометрии.
Основной задачей наших исследований была оценка влияния экспериментального препарата на активизацию митохондрий организма.
Методика исследований
В работе использовали новый препарат, который представляет собой раствор метаналя, в изотоническом водном растворе хлорида натрия, полученный по оригинальной технологии с использованием методов приготовления препаратов, активная составляющая которых растворена в носителе в сверхмалой дозе (патент РФ № 2765467) [2]. Препарат хранили в тёмном месте при температуре от +15 до +35°С.
Всего в исследованиях использовалось 110 половозрелых мышей (самцы) гибридов F1 (СВАхС57Вl6), полученных из питомника Федерального медико-биологического агентства (ФМБА России), имевших ветеринарный сертификат и прошедших карантин в виварии. Животные находились в стандартных полипропиленовых боксах для содержания животных в условиях вивария, при естественном световом режиме, на стандартном пищевом рационе со свободным доступом к поилкам с водой.
Экспериментальный препарат вводили однократно внутримышечно в дозе 12,5 мл/кг, что соответствовало 0,25 мл препарата на мышь (масса тела мышей в среднем составляла 20,5±0,24 г.). Вывод животных из эксперимента осуществляли методом декапитации через 1, 3 и 24 часа после введения препарата (соответственно группе животных). Контрольным животным вводили внутримышечно 0,25 мл 0,9 % раствора хлористого натрия (физиологический раствор).
Оценка активности митохондрий под влиянием экспериментального препарата проводилась в нескольких группах животных: 1 группа (10 голов) - контроль (животные получали аналогичный испытуемому препарату объем физиологического раствора (0,9% раствор NaCl); 2 группа (20 голов) – животные, получившие указанную дозу препарата и подвергнутые эвтаназии через 1 час от введения; 3 группа (20 голов) – животные, получившие указанную дозу препарата и подвергнутые эвтаназии через 3 часа после введения; 4 группа (20 голов) – животные, получившие указанную дозу препарата и подвергнутые эвтаназии через 24 часа после введения; 5 группа (20 голов) – животные, получившие препарат и подвергнутые эвтаназии через 3 недели от введения препарата; 6 группа (20 голов) – животные, получившие препарат двукратно (1-одномоментно с животными 2-5 групп и повторное введение через 3 недели после первого) и подвергнутые эвтаназии через 3 часа после повторного введения. Режим содержания и кормления обеспечивали согласно стандартам, указанным в руководстве Guidefor Care and Useof Laboratory Animals [11].
Для оценки митохондриальной активности клеток крови мышей использовали оценку потенциала мембраны митохондрий с применением митохондриального флуоресцентного красителя JC-1, а также оценку пропорции клеток с признаками апоптоза на основании оценки пропорции BCL2+ популяций. Оба показателя оценивались иммунологически с применением метода проточной цитометрии; оценки кислородзависимой активации нейтрофилов методом хемилюминесценции.
В первом тесте произведена индивидуальная оценка активности митохондрий клеток крови каждого животного, во втором тесте для достижения адекватных результатов кровь животных пулировалась, при этом для каждой группы животных оценено 2 образца – кровь контрольной группы и пулированная кровь опытной группы.
Анализ данных проточной цитометрии проводили с применением программного обеспечения Kaluza Analysis Version 2.2.1 и FSC 3.0. Для каждого анализируемого образца оценивали интенсивность экспрессии анализируемых маркеров в различных субпопуляциях лейкоцитов и сравнивали с интенсивностью в контроле при оценке мембранного потенциала мембраны митохондрий оценивалась пропорция мономеров и агрегатов по соотношению красителей JC1-red vs JC1 green (пример представлен на рисунке 1 (А-Г)).
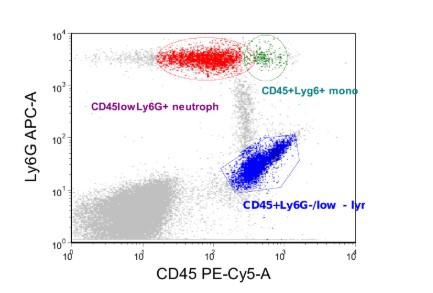
А. Оцениваемые популяции
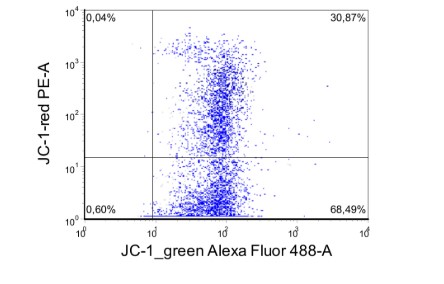
Б – пропорция мономеров ( правый нижний квадрант) – 68,5%
Пропорция агрегатов (активированные клетки, правый верхний квадрант) – 30,8% в пределах популяции лимфоцитов крови мыши
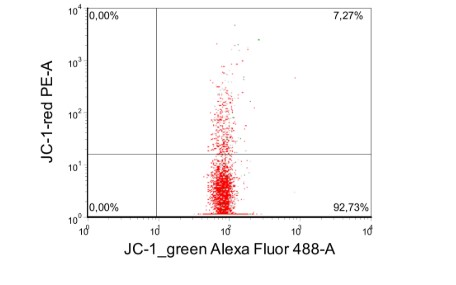
В - пропорция мономеров (правый нижний квадрант) – 92,7%
Пропорция агрегатов (правый верхний квадрант) – 7,3% в пределах нейтрофилов
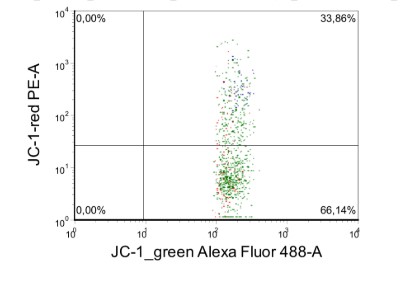
Г - пропорция мономеров (правый нижний квадрант) – 66,1%
Пропорция агрегатов (правый верхний квадрант) – 33,8% в пределах моноцитов периферической крови мыши
Рисунок 1. Пример оценки мембранного потенциала митохондрий различных популяций лейкоцитов одного экспериментального животного.
Статистическую обработку экспериментальных данных проводили с помощью стандартного пакета программ Microsoft Office Excel 2010. Оценку достоверности различий осуществляли с применением параметрического t-критерия Стьюдента. Различия считали достоверными (значимыми) при уровне вероятности 95% и более (р <0,05). Данные представлены как среднее ± стандартная ошибка средней.
Результаты и их обсуждение
Результаты оценки кислородзависимой активации нейтрофилов показали, что воздействие экспериментального препарата на митохондрии нейтрофилов зависит от схемы введения.
Так спустя 3 часа после внутримышечного введения препарата изменения показателей кислородзависимого метаболизма нейтрофилов крови не выявлены (таблица 1), а скорее даже несколько подавлены. А уже через 24 часа после внутримышечного введения препарата было достигнуто достоверное увеличение показателя хемилюминесценции Imax в 4,6 раза по сравнению с контролем.
Таблица 1.
Результаты исследования кислородзависимой активации нейтрофилов методом хемилюминесценции через 3 часа и через 24 часа после введения препарата
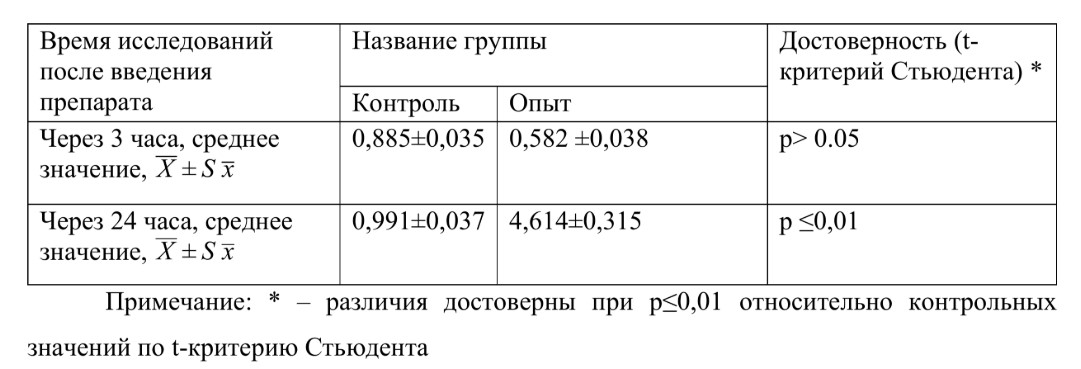
Полученные данные позволяют говорить о существенном повышении кислородзависимого метаболизма нейтрофилов под влиянием испытуемого препарата, что опосредованно можно расценить как активацию митохондрий в данной клеточной субпопуляции.
Результаты исследований кислородзависимой активации нейтрофилов методом хемилюминесценции через 3 недели после внутримышечного однократного введения препарата (группа 5, пул из 5 животных) показали тенденцию к 2-кратному повышению активности нейтрофилов (рисунок 2) по сравнению с контролем. После двукратного внутримышечного введения препарата (группа 6, пул из 5 животных) также выявлена разница в активации нейтрофилов в сравнении с контролем, но в целом при этом однократное введение препарата было более эффективным в сравнении с двукратным введением.
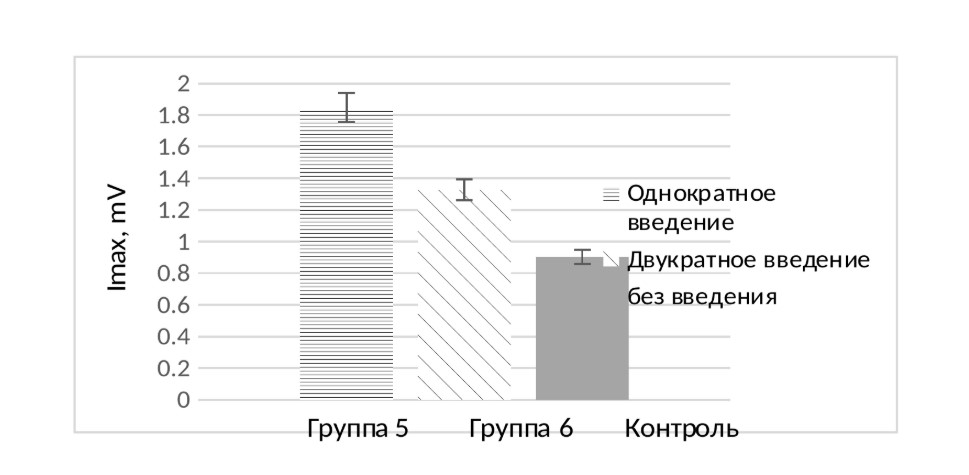
Рисунок 2. Результаты исследования кислородзависимой активации нейтрофилов методом хемилюминесценции через 3 недели после внутримышечного введения препарата
На рисунке 3 представлено сравнение средних показателей хемилюминесценции во всех анализируемых группах. По горизонтальной оси указано время исследования крови биомоделей после инъекции препарата, а по вертикальной оси – результаты показателя хемилюминесценции Imax, mV. Видно, что под влиянием препарата проявляется кислород-зависимая активация нейтрофилов. При этом максимальный эффект выявлен через сутки после введения препарата и сохранялся в течение трех недель, постепенно снижаясь.
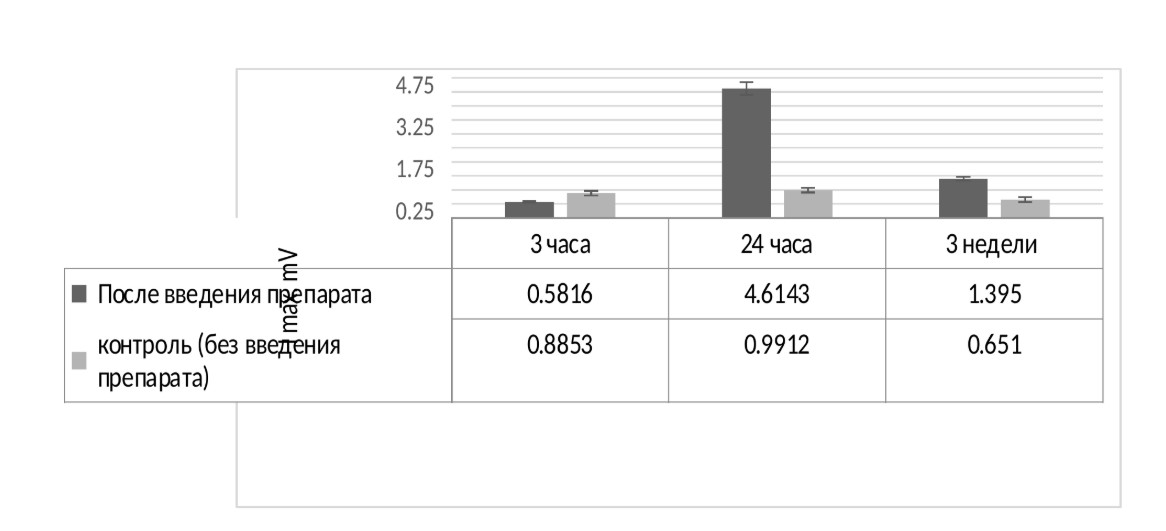
Рисунок 3. Сравнение средних показателей кислородзависимой активации нейтрофилов методом хемилюминесценции в опытных и контрольной группах
При анализе экспрессии флуоресцентных красителей, отражающих активность мембраны митохондрий через один час и через три часа после введения препарата мышам, достаточно отчетливо выявлялся наблюдаемый у большей части особей сдвиг плотности экспрессии в сторону красного спектра, т.е. появление популяции агрегатов, что свидетельствовало о начальных этапах активации митохондрий. Наиболее отчетливо эта тенденция проявилась на нейтрофилах и моноцитах крови.
Дальнейший анализ показал, что через сутки под влиянием препарата у животных появляется явная тенденция повышения количества агрегатов среди популяций лимфоцитов крови (таблица 2), что, опосредовано, говорит об активации митохондрий.
Таблица 2
Сравнительный анализ показателей мембранного потенциала митохондрий на основании оценки JC-1 мономеров/агрегатов у мышей-гибридов F1 (СВА x C57BL6) через 24 часа после введения препарата
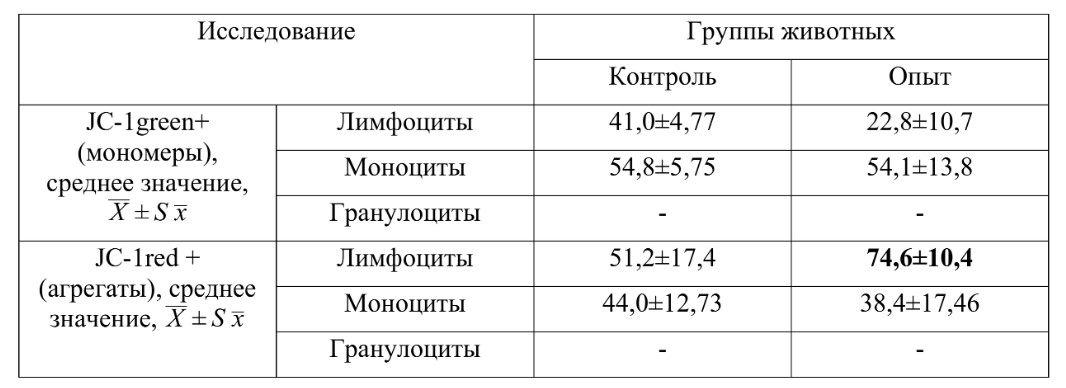
При оценке экспрессии белка апоптоза BCL-2 через 24 часа после введения препарата отчетливой пропорции клеток с признаками апоптоза практически не выявило – единичные АГ+ клетки позволяют расценить полученные данные как признак активации, а не апоптоза.
При анализе влияния препарата на более длительных сроках (через 3 недели после введения препарата) установлено присутствие более выраженной пропорции JC-1+ агрегатов как у животных с одним введением, так и у животных, получивших 2 дозы препарата в сравнении с контрольной группой. Более отчетливо это выявлялось на лимфоцитарных популяциях. Результаты по оценке нейтрофилов-моноцитов были более гетерогенными: у части особей был отмечен эффект, а у части животных данные были сопоставимы с животными контрольной группы.
Заключение
Результаты оценки мембранного потенциала митохондрий и количества BCL-2+ клеток показали, что через несколько часов после введения препарата происходит активация митохондрий, что проявляется в поляризации их мембраны. Данные процессы выявлены в разные сроки после введения препарата и в различных клеточных популяциях. На более ранних сроках наибольший и равномерный эффект проявился у моноцитов, в то время как более длительное воздействие препарата приводило к поляризации мембран в лимфоцитах и у некоторых клеток в суммарной популяции моноцитов-нейтрофилов крови.
При анализе экспрессии флуоресцентных красителей, отражающих активность мембраны митохондрий через один час и через три часа после введения препарата мышам, достаточно отчетливо выявлялся наблюдаемый у большей части особей сдвиг плотности экспрессии в сторону красного спектра, т.е. появление популяции агрегатов, что свидетельствовало о начальных этапах активации митохондрий. Наиболее отчетливо эта тенденция проявилась на нейтрофилах и моноцитах крови.
Показано, что под влиянием экспериментального препарата наибольший эффект проявлялся через сутки при однократном введении препарата, когда показатели кислородзависимой активации были увеличены в 4.6 раза по сравнению с контролем и сохранялись до трех недель постепенно снижаясь, при двукратном введении эффект был в два раза ниже.
Таким образом, подтверждено влияние экспериментального препарата на мембранный потенциал митохондрий клеток крови лабораторных животных. Препарат вызывает поляризацию внутренних мембран митохондрий, приводя их к активизации и усиливая аэробное окисление и, следовательно, более интенсивную выработку энергии.
Конфликт интересов отсутствует.
Список литературы
1. Зорова Л.Д., Попков В.А., Плотников Е.Ю. и др. Функциональная значимость митохондриального мембранного потенциала // Биологические мембраны. М.: ФГБУ "Издательство "Наука". 2017. Т. 34. № 6. С. 93-100.
2. Ласкавый В.Н., Шурдов М.А. Патент РФ № 2765467. «Средство для коррекции митохондриальной дисфункции». Опуб. 31.01.2021.
3. Мазунин И.О., Володько Н.В. Митохондрии: жизнь в клетке и ее последствия // Природа. М.: ФГБУ "Издательство "Наука". 2010. № 10. С. 3–14.
4. Снигиревская Е.С., Комиссарчик Я.Ю. Ультраструктурные изменения внутриклеточных органелл при апоптозе / Биосфера. СПб: Фонднаучныхисследований XXI век. 2018. Т.10. №2. С. 122–142.
5. Dorokhov Y.L., Sheshukova E.V., Bialik T.E., Komarova T.V. Human Endogenous Formaldehyde as an Anticancer Metabolite: Its Oxidation Downregulation May Be a Means of Improving Therapy //BioEssays 2018, 1800136
6. Hopkinson R.J., Schofield C.J. Deciphering Functions of Intracellular Formaldehyde: Linking Cancer and Aldehyde Metabolism// Biochemistry 2018, 57, 6, 904-906
7. Kleinnijenhuis AJ, Staal YC, Duistermaat E, Engel R, Woutersen RA. The determination of exogenous formaldehyde in blood of rats during and after inhalation exposure. Food Chem Toxicol. 2013 Feb;52:105-12. doi: 10.1016/j.fct.2012.11.008. Epub 2012 Nov 14. PMID: 23159914.
8. Mao C. C., Holt IJ. Clinical and molecular aspects of diseases of mitochondrial DNA instability // Chang Gung medical journal. 2009. Vol. 32. P. 354–369.
9. McInerny S. C., Brown A.L, Smith D.W. Region-specific changes in mitochondrial D-loop in aged rat CNS // Mechanisms of ageing and development. 2009. Vol. 130. Issue 5. P. 343–349. doi: 10.1016/j.mad.2009.01.008.
10. Michiels TJM, Schöneich C, Hamzink MRJ, Meiring HD, Kersten GFA, Jiskoot W, Metz B. Novel Formaldehyde-Induced Modifications of Lysine Residue Pairs in Peptides and Proteins: Identification and Relevance to Vaccine Development. Mol Pharm. 2020 Nov 2;17(11):4375-4385. doi: 10.1021/acs.molpharmaceut.0c00851. Epub 2020 Oct 5. PMID: 33017153.
11. National Academies of Sciences, Engineering, and Medicine. 2011. Guide for the Care and Use of Laboratory Animals: Eighth Edition. Washington, DC: The National Academies Press. https://doi.org/10.17226/12910.
12. Salvioli S., Maseroli R., Pazienza T.L. and others. Use of flow cytometry as a tool to study mitochondrial membrane potential in isolated, living hepatocytes //. Biochemistry (Moscow). 1998. Vol. 63. Issue 2. P. 235-238.
13. Serviddio G., Bellanti F., Vendemiale G. Free radical biology for medicine: learning from nonalcoholic fatty liver disease // Free Radical Biology and Medicine. 2013. Vol. 65 (Dec). P. 952–968. doi: 10.1016/j.freeradbiomed.2013.08.174.
14. Sivandzade F, Bhalerao A, Cucullo L. Analysis of the Mitochondrial Membrane Potential Using the Cationic JC-1 Dye as a Sensitive Fluorescent Probe // Bio Protoc. 2019 Jan 5;9(1):e3128. doi: 10.21769/BioProtoc.3128. PMID: 30687773; PMCID: PMC6343665.
15. Song, X. Han X., Yu F., Zhang J., Chen L., Lv C. A reversible fluorescent probe based on C[double bond, length as m-dash]N isomerization for the selective detection of formaldehyde in living cells and in vivo.//The Analyst 2018,143, 429;
16. Zapico S.C., Ubelaker D.H. mtDNA Mutations and Their Role in Aging, Diseases and Forensic Sciences // Aging Dis. 2013. Vol. 4. № 6. P. 364–380. doi: 10.14336/AD.2013.0400364.
УДК 615.03:576.08:57.021
The use a new methanal-based drug to activate mitochondria
Laskavyy V.N.1, Shurdov M.A.2, Grivtsova L.Yu..3, Polyanina T.I.1, Golova A.B. 1, Simonenko N.V.1, Kuznetsova A.E.1, Laskavaya V.V.1 Tarasenko T.N. 1
1Limited Liability Company "SARBIOTEKH", 410037, Saratov Region, Saratov, Ust-Kurdyumskaya St., 4, office 174, Russian Federation.
2Joint-Stock Company Clinical Hospital "Neurovita", 121359 Moscow, Marshal Timoshenko St., 7с1, Russian Federation.
3Medical Radiological Research Center named after A.F. Tsyb - branch of the Federal State Budgetary Institution "National Medical Research Center of Radiology" of the Ministry of Health of the Russian Federation", 249031, Kaluga Region, Obninsk, Marshal Zhukov St., 10, Russian Federation
The article presents the results of studies of the developed drug based on 0.07% methanal (formic acid aldehyde) solution on mitochondria activation. Its ability to cause polarization of the internal mitochondrial membranes in the blood cells of biomodels, leading to their activation and more intensive energy production (RU Patent No. 2765467) has been proven. The greatest effect appears after 24 hours and lasts up to three weeks after a single injection of the drug.
Activation of mitochondria has been detected in various cell populations and depends on the time after injection of the drug. The greatest effect is manifested in monocytes in the early stages, and later - in lymphocytes.
In our opinion, the possibility of activating mitochondria and a possible reduction in mutations in mitochondrial DNA is a key point that allows for a significant increase in the lifespan of mammals in the future.
Key words: mitochondria, membrane polarization, flow cytometry, linear CBA mice, longevity
Ласкавый Владислав Николаевич1,
доктор ветеринарных наук, заслуженный ветеринарный врач РФ, научный сотрудник, sarvlad47@bk.ru
Шурдов Михаил Аркадьевич2,
кандидат биологических наук, председатель Совета Директоров, shurdov@gmail.com
Гривцова Людмила Юрьевна3,
доктор биологических наук, Заведующий отделением клинической иммунологии, grivtsova@mail.ru
Полянина Татьяна Ивановна1,
кандидат биологических наук, заместитель генерального директора по науке, polyanina_ti@mail.ru
Голова Алина Борисовна1,
кандидат биологических наук, старший научный сотрудник, alinagolova@mail.ru
Симоненко Наталья Валерьевна1,
кандидат биологических наук, ведущий научный сотрудник, natalia000polivanovka@gmail.com
Кузнецова Анна Евгеньевна1,
кандидат биологических наук, ведущий научный сотрудник, shirokova-7575@mail.ru
Ласкавая Вера Владиславовна1,
старший научный сотрудник, vlaskavaya@list.ru
Тарасенко Татьяна Николаевна1,
научный сотрудник, gerda-vitta@mail.ru,
1Общество с ограниченной ответственностью «САРБИОТЕХ», г. Саратов, Российская Федерация
2АО Клинический госпиталь "Нейровита",
2МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России















